- Historie položek
- Obecné vlastnosti cínu
- Slitiny na bázi cínu
- Použití prvku a jeho propojení
- Účinky cínových sloučenin
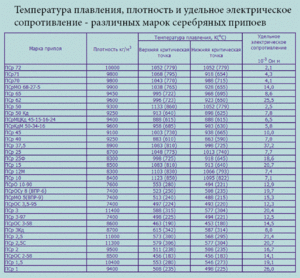 Cín je měkký stříbro-bílý kov. Je natolik poddajný a poddajný, že jeho listy tisíce milimetrů tlusté mohou být srolovány do trubky. Takový materiál se nazývá cínový papír. V periodické tabulce prvků D. I. Mendeleeva tento prvek odpovídá číslu 50, atomové hmotnosti 118, 69 a znaku „Sn“ (latinský stannum). Je známo 10 jeho stabilních izotopů. Kov je získáván hlavně z minerálu kasiteritu, kterým je oxid cínu.
Cín je měkký stříbro-bílý kov. Je natolik poddajný a poddajný, že jeho listy tisíce milimetrů tlusté mohou být srolovány do trubky. Takový materiál se nazývá cínový papír. V periodické tabulce prvků D. I. Mendeleeva tento prvek odpovídá číslu 50, atomové hmotnosti 118, 69 a znaku „Sn“ (latinský stannum). Je známo 10 jeho stabilních izotopů. Kov je získáván hlavně z minerálu kasiteritu, kterým je oxid cínu.
K pájení se používá převážně kov ve slitině s olovem. Kromě toho se používá jako antikorozní povlak pro nádoby z potravinářské oceli, protože není toxický. Kompozity s cínem se používají jako fungicidy, barvy, zubní pasty (SnF2) a keramika.
Historie položek
 Tento prvek objevil v roce 1854 Halyus Pelegrin. Jeho používání však začalo dlouho před tímto datem na Blízkém východě a na Balkáně kolem roku 2000 před naším letopočtem. V té době byl objeven bronz (slitina cínu a mědi), což dalo jméno doba bronzová. Vyráběli bronzové zbraně a nástroje, které byly účinnější než kámen a kosti.
Tento prvek objevil v roce 1854 Halyus Pelegrin. Jeho používání však začalo dlouho před tímto datem na Blízkém východě a na Balkáně kolem roku 2000 před naším letopočtem. V té době byl objeven bronz (slitina cínu a mědi), což dalo jméno doba bronzová. Vyráběli bronzové zbraně a nástroje, které byly účinnější než kámen a kosti.
Ve starověku vedla výroba bronzu k rozvoji obchodu mezi různými zeměmi. Ve Starém zákoně jsou také odkazy na tento kov. Takže v Mezopotámii vyráběli bronzové zbraně a ve starém Římě pokryli cínem vnitřní povrch měděných nádob, aby zvýšili odolnost proti korozi.
Obecné vlastnosti cínu
Všechny vlastnosti tohoto kovu lze rozdělit do dvou velkých skupin : fyzikální a chemické.
Fyzikální vlastnosti
 Je to stříbrný kujný kov, který snadno oxiduje při okolní teplotě, zatímco barva cínu se mění na tmavě šedou. Pokud ohnete desku z tohoto kovu, uslyšíte charakteristický zvuk, tzv. „Cínový pláč“, ke kterému dochází díky tření mezi jeho krystaly. Jednou z jeho výrazných charakteristik je prudké zhoršení mechanických vlastností za určitých podmínek, zvané „mor cínu“: pod -18 ° C je kov zničen a začíná vypadat jako šedý prášek.
Je to stříbrný kujný kov, který snadno oxiduje při okolní teplotě, zatímco barva cínu se mění na tmavě šedou. Pokud ohnete desku z tohoto kovu, uslyšíte charakteristický zvuk, tzv. „Cínový pláč“, ke kterému dochází díky tření mezi jeho krystaly. Jednou z jeho výrazných charakteristik je prudké zhoršení mechanických vlastností za určitých podmínek, zvané „mor cínu“: pod -18 ° C je kov zničen a začíná vypadat jako šedý prášek.
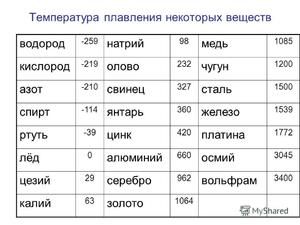
Čistý cín má dvě allotropické modifikace: šedou a bílou. Šedá modifikace má kubickou krystalickou strukturu, je polovodič, velmi křehká, má nízkou hustotu a je stabilní při teplotách pod 13, 2 ° C. Bílá allotropická modifikace má tetragonální krystalickou strukturu, dobře vede elektrický proud a je stabilní při teplotách nad 13, 2 ° C.
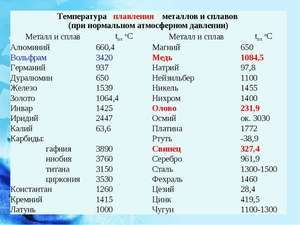
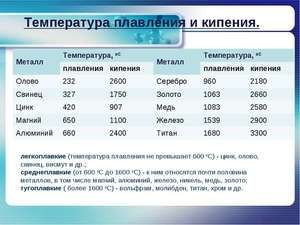
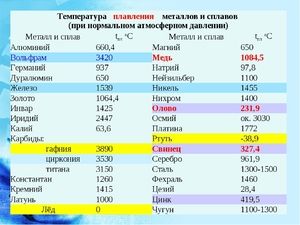
Kov taje při relativně nízké teplotě 232 ° C (pro srovnání: železo taje při 1535 ° C). Je třeba pochopit, odpovědět na otázku, za jakých teplot se cín taví, co přesně se taví její bílá alotrópická modifikace. Navzdory nízkému bodu tání dochází k varu kovu při relativně vysoké teplotě 2602 ° C (železo se vaří při 2750 ° C).
Chemické vlastnosti
 Nejdůležitějším minerálem je kasiterit, SnO2. V současné době však není známo ložisko rudy s vysokým procentem tohoto minerálu. Většina cassiterite na světě je těžena z nízkých kvalitativních náplavových ložisek. Z tohoto minerálu se cín vyrábí v průmyslovém měřítku. Za tímto účelem je kasiterit rozdrcen, aby se získal jeho koncentrát, a poté se roztaví společně s koksem, křemenem a vápnem ve vysoké peci. Poté odlitky ve formě bloků procházejí finálním čištěním od nečistot vizmutu, mědi a železa.
Nejdůležitějším minerálem je kasiterit, SnO2. V současné době však není známo ložisko rudy s vysokým procentem tohoto minerálu. Většina cassiterite na světě je těžena z nízkých kvalitativních náplavových ložisek. Z tohoto minerálu se cín vyrábí v průmyslovém měřítku. Za tímto účelem je kasiterit rozdrcen, aby se získal jeho koncentrát, a poté se roztaví společně s koksem, křemenem a vápnem ve vysoké peci. Poté odlitky ve formě bloků procházejí finálním čištěním od nečistot vizmutu, mědi a železa.
Chemický prvek cín dobře reaguje se silnými kyselinami i silnými zásadami, ale v neutrálních roztocích je relativně inertní. Je zkorodován v přítomnosti oxidačního média, v nepřítomnosti kyslíku kov prakticky nekoroduje. Během oxidace se na povrchu kovu tvoří hustý oxidový film, který zbytek chrání před další oxidací.
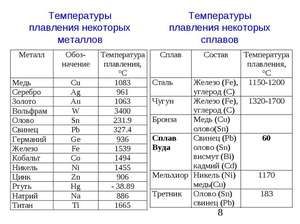 Pokud se kyselé médium vytvoří po rozpuštění solí ve vodě, pak v přítomnosti oxidačních činidel nebo vzduchu cín reaguje. Takové soli zahrnují chloridy, například hliník a železo. Většina nevodných kapalin, jako jsou oleje a alkoholy, prakticky nereagují s cínem. Samotný cín a jeho jednoduché anorganické soli nejsou toxické, avšak některé organické kompozity jsou toxické.
Pokud se kyselé médium vytvoří po rozpuštění solí ve vodě, pak v přítomnosti oxidačních činidel nebo vzduchu cín reaguje. Takové soli zahrnují chloridy, například hliník a železo. Většina nevodných kapalin, jako jsou oleje a alkoholy, prakticky nereagují s cínem. Samotný cín a jeho jednoduché anorganické soli nejsou toxické, avšak některé organické kompozity jsou toxické.
Oxid cínu (II), SnO je černo-modrý krystal, který se rozpustí v kyselinách a zásadách. Používá se pro výrobu solí při galvanickém pokovování a při výrobě skla. Oxid cínatý, SnO2 je bílý prach, nerozpustný v kyselinách. Používá se jako nezbytná složka pro barvení v růžové, žluté a hnědé keramice, jakož i v dielektrikách a žáruvzdorných slitinách. Je to důležitý prostředek při leštění mramoru a dalších dekorativních kamenů.
Chlorid cínatý, SnCl2 je hlavní složkou kyseliny cínu pro pájení. Chlorid cínatý, SnCl4 se používá jako chemická složka, která váží hedvábnou tkaninu a také stabilizuje určité parfémové výrobky a stabilizuje barvu mýdla, a SnF2, který je bílý a rozpustný ve vodě, se používá jako přísada do zubních past.
Organické chemické sloučeniny založené na tomto prvku jsou ty sloučeniny, ve kterých je přítomna alespoň jedna vazba cínu a vodíku, Sn-H, a ve které kov vykazuje oxidační stav +4. Organické sloučeniny, které našli uplatnění v průmyslu, mají následující chemické vzorce:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Zde R je organická skupina, například methyl, ethyl, butyl a další, a X je anorganický prvek, například chlor, kyslík, flóra a další.
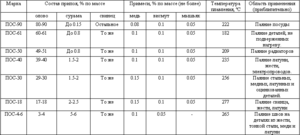
Slitiny na bázi cínu
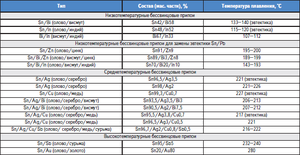 Slitiny na bázi cínu jsou také známé jako bílé kovy, obvykle obsahující měď, antimon a olovo. Slitiny mají různé mechanické vlastnosti v závislosti na jejich složení.
Slitiny na bázi cínu jsou také známé jako bílé kovy, obvykle obsahující měď, antimon a olovo. Slitiny mají různé mechanické vlastnosti v závislosti na jejich složení.
Slitiny cínu a olova našli své komerční využití pro širokou škálu sloučenin. Takže 61, 9% cínu a 38, 1% olova odpovídá eutektické kompozici, jejíž stupeň tuhnutí je 183 ° C. Slitiny s rozdílným poměrem těchto kovů se taví a krystalizují v širokém teplotním rozmezí, když je rovnováha mezi pevnou a kapalnou fází. S takovou krystalizací začnou v tavenině precipitovat pevné segregace, což vede k tvorbě různých struktur. Eutektická slitina, protože má nejnižší bod tání, se používá jako ochrana proti přehřátí elektronických součástek.
Existují také slitiny, ve kterých je kromě těchto kovů přítomno malé množství antimonu (až 2, 5%). Hlavním problémem slitin na bázi cínu a olova je jejich negativní dopad na životní prostředí, proto byly nedávno vyvinuty jejich náhražky, ve kterých se olovo nepoužívá, například slitiny se stříbrem a mědí.
Slitiny cínu s olovem a antimonem se používají pro ozdobné klenoty a některé slitiny cínu, mědi a antimonu se používají jako mazivo ke snížení tření v ložiscích v důsledku jejich antikrihových vlastností. Kromě výše uvedených slitin se cín používá v bronzových slitinách a ve slitinách s titanem a zirkoniem.
Použití prvku a jeho propojení
Níže jsou uvedeny všechny oblasti lidské výroby, v nichž se tento prvek přímo nebo nepřímo používá:
 Ochrana proti korozi a mechanickému namáhání ocelí a jiných kovů, například při výrobě plechovek;
Ochrana proti korozi a mechanickému namáhání ocelí a jiných kovů, například při výrobě plechovek;- Snížení křehkosti skla a výroby zrcadel;
- V pronásledovaných vzorech na různých pokrmech;
- Použití ve fungicidech, barvách, zubních pastách a různých pigmentech.
- Po přijetí různých slitin, například bronzů.
- Pro pájení při nízké teplotě nebo měkké pájení;
- Složený olovem při výrobě plechů pro hudební nástroje;
- Výroba etiket různých produktů;
- Ve slitinách, které chrání před přehřátím elektrických přístrojů a elektronických mikroobvodů;
- V keramickém průmyslu na výrobu smaltů jako matovacího činidla.
- V kapslích pro láhve na víno. Výroba těchto tobolek se po zákazu používání olova v potravinářském průmyslu rozšířila.
Účinky cínových sloučenin
Aktivita sloučenin s tímto prvkem tak či onak ovlivňuje lidské tělo i životní prostředí.
O lidském zdraví
 Jak již bylo uvedeno, nejnebezpečnější pro lidské zdraví jsou organické chemické sloučeniny cínu. Tyto látky se široce používají v průmyslu, například při výrobě barev, plastů a pesticidů pro zemědělství. Kromě toho výroba organických sloučenin s tímto kovem neustále roste, a to i přesto, že jsou známy důsledky otravy jimi .
Jak již bylo uvedeno, nejnebezpečnější pro lidské zdraví jsou organické chemické sloučeniny cínu. Tyto látky se široce používají v průmyslu, například při výrobě barev, plastů a pesticidů pro zemědělství. Kromě toho výroba organických sloučenin s tímto kovem neustále roste, a to i přesto, že jsou známy důsledky otravy jimi .
Účinky těchto látek na člověka jsou rozmanité, vše záleží na typu sloučeniny a na individuálních vlastnostech těla. Nebezpečí sloučeniny koreluje s délkou vazby mezi kovem a vodíkem, čím delší je tato vazba, tím méně je spojení nebezpečné. V tomto ohledu se za nejnebezpečnější organickou látku považuje sloučenina cínu se třemi ethylovými skupinami, jejichž vodíkové vazby jsou relativně krátké.
Tyto látky se mohou dostat do lidského těla potravou, vzduchovými kapičkami nebo pouhým dotykem. Jsou známy následující účinky účinků organických sloučenin cínu na lidské tělo:
- V místnosti obsahující výpary tohoto kovu silné podráždění horních cest dýchacích, kůže a očí;
- Bolesti hlavy, bolesti žaludku a nedostatek chuti k jídlu;
- Nevolnost a zvracení;
- Problémy s močením;
- Těžké pocení a dušnost.
Uvedené účinky mohou vést k vážnějším následkům:
- Deprese
- Problémy s játry;
- Poškozený imunitní systém
- Poškození buněčných chromozomů a nedostatek červených těl v krvi;
- Poškození mozku (poruchy spánku, bolesti hlavy, selhání paměti, podrážděný stav).
Do životního prostředí
 Atomy cínu i samotný kov v čistém stavu nejsou toxické pro žádný organismus na Zemi, naopak téměř všechny sloučeniny s tímto prvkem organické povahy jsou škodlivé. Tyto sloučeniny mohou být v prostředí po dlouhou dobu. Jsou poměrně stabilní a prakticky se nerozkládají pod vlivem mikroorganismů kvůli jejich silným vodíkovým vazbám. Bez ohledu na to, jak nízká je koncentrace sloučenin tohoto kovu v půdě a vodě, vzhledem k výše uvedenému neustále rostou.
Atomy cínu i samotný kov v čistém stavu nejsou toxické pro žádný organismus na Zemi, naopak téměř všechny sloučeniny s tímto prvkem organické povahy jsou škodlivé. Tyto sloučeniny mohou být v prostředí po dlouhou dobu. Jsou poměrně stabilní a prakticky se nerozkládají pod vlivem mikroorganismů kvůli jejich silným vodíkovým vazbám. Bez ohledu na to, jak nízká je koncentrace sloučenin tohoto kovu v půdě a vodě, vzhledem k výše uvedenému neustále rostou.
Je známo, že organické sloučeniny cínu způsobují velké poškození vodním ekosystémům, protože jsou toxické pro houby, řasy a fytoplankton. Phytoplankton je důležitou součástí vodního ekosystému, protože produkuje kyslík pro všechny ostatní živé organismy tohoto systému a je také důležitou součástí potravinového řetězce. Toxicita sloučenin cínu se liší pro různé živé věci, například tributylcín je toxický pro ryby a houby, zatímco trifenolový cín je pro fytoplankton nej toxičtější sloučeninou.
Je také známo, že organické sloučeniny tohoto prvku mají negativní vliv na růst a reprodukční funkci zvířat, narušují fungování enzymů. Takové sloučeniny se hromadí hlavně v horních vrstvách půdy a vody.